Po prvé, štruktúra a vlastnosti kryštálu SiC.
SiC je binárna zlúčenina tvorená prvkom Si a prvkom C v pomere 1:1, teda 50 % kremíka (Si) a 50 % uhlíka (C), a jej základnou štruktúrnou jednotkou je štvorsten SI-C.
Schematický diagram štruktúry štvorstenu karbidu kremíka
Napríklad atómy Si majú veľký priemer, ekvivalent jablka, a atómy C malý priemer, ekvivalent pomaranča, a rovnaký počet pomarančov a jabĺk je nahromadených, aby vytvorili kryštál SiC.
SiC je binárna zlúčenina, v ktorej je vzdialenosť atómov väzby Si-Si 3,89 A, ako rozumieť tejto vzdialenosti? V súčasnosti má najlepší litografický stroj na trhu presnosť litografie 3nm, čo je vzdialenosť 30A a presnosť litografie je 8-krát väčšia ako atómová vzdialenosť.
Energia väzby Si-Si je 310 kJ/mol, takže môžete pochopiť, že energia väzby je sila, ktorá oddeľuje tieto dva atómy, a čím väčšia je energia väzby, tým väčšia je sila, ktorú musíte roztiahnuť.
Napríklad atómy Si majú veľký priemer, ekvivalent jablka, a atómy C malý priemer, ekvivalent pomaranča, a rovnaký počet pomarančov a jabĺk je nahromadených, aby vytvorili kryštál SiC.
SiC je binárna zlúčenina, v ktorej je vzdialenosť atómov väzby Si-Si 3,89 A, ako rozumieť tejto vzdialenosti? V súčasnosti má najlepší litografický stroj na trhu presnosť litografie 3nm, čo je vzdialenosť 30A a presnosť litografie je 8-krát väčšia ako atómová vzdialenosť.
Energia väzby Si-Si je 310 kJ/mol, takže môžete pochopiť, že energia väzby je sila, ktorá oddeľuje tieto dva atómy, a čím väčšia je energia väzby, tým väčšia je sila, ktorú musíte roztiahnuť.
Schematický diagram štruktúry štvorstenu karbidu kremíka
Napríklad atómy Si majú veľký priemer, ekvivalent jablka, a atómy C malý priemer, ekvivalent pomaranča, a rovnaký počet pomarančov a jabĺk je nahromadených, aby vytvorili kryštál SiC.
SiC je binárna zlúčenina, v ktorej je vzdialenosť atómov väzby Si-Si 3,89 A, ako rozumieť tejto vzdialenosti? V súčasnosti má najlepší litografický stroj na trhu presnosť litografie 3nm, čo je vzdialenosť 30A a presnosť litografie je 8-krát väčšia ako atómová vzdialenosť.
Energia väzby Si-Si je 310 kJ/mol, takže môžete pochopiť, že energia väzby je sila, ktorá oddeľuje tieto dva atómy, a čím väčšia je energia väzby, tým väčšia je sila, ktorú musíte roztiahnuť.
Napríklad atómy Si majú veľký priemer, ekvivalent jablka, a atómy C malý priemer, ekvivalent pomaranča, a rovnaký počet pomarančov a jabĺk je nahromadených, aby vytvorili kryštál SiC.
SiC je binárna zlúčenina, v ktorej je vzdialenosť atómov väzby Si-Si 3,89 A, ako rozumieť tejto vzdialenosti? V súčasnosti má najlepší litografický stroj na trhu presnosť litografie 3nm, čo je vzdialenosť 30A a presnosť litografie je 8-krát väčšia ako atómová vzdialenosť.
Energia väzby Si-Si je 310 kJ/mol, takže môžete pochopiť, že energia väzby je sila, ktorá oddeľuje tieto dva atómy, a čím väčšia je energia väzby, tým väčšia je sila, ktorú musíte roztiahnuť.
Vieme, že každá látka sa skladá z atómov a štruktúra kryštálu je pravidelným usporiadaním atómov, ktoré sa nazýva rád s dlhým dosahom, ako je nasledujúci. Najmenšia kryštálová jednotka sa nazýva bunka, ak je bunkou kubická štruktúra, nazýva sa to tesne zbalená kubická a bunka je šesťuholníková štruktúra, nazýva sa to tesný šesťuholník.
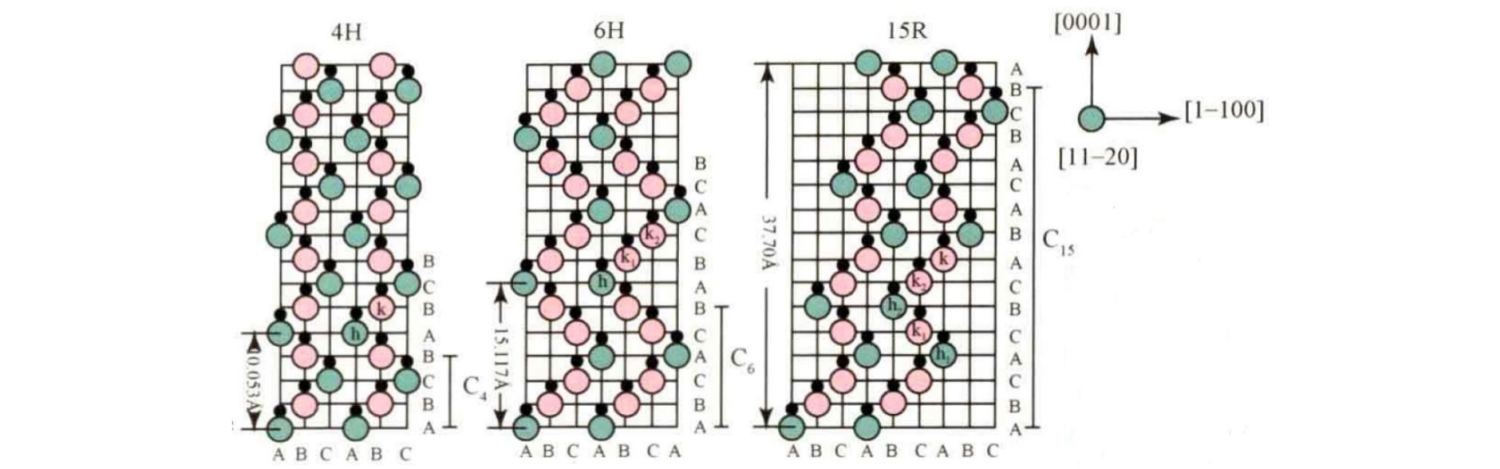
Bežné typy kryštálov SiC zahŕňajú 3C-SiC, 4H-SiC, 6H-SiC, 15R-SiC atď. Ich poradie ukladania v smere osi c je znázornené na obrázku.
Medzi nimi je základná postupnosť stohovania 4H-SiC ABCB...; Základná postupnosť stohovania 6H-SiC je ABCACB... ; Základná postupnosť stohovania 15R-SiC je ABCACBCABACABCB... .
Toto možno považovať za tehlu na stavbu domu, niektoré tehly domu majú tri spôsoby umiestnenia, niektoré štyri spôsoby umiestnenia, niektoré šesť spôsobov.
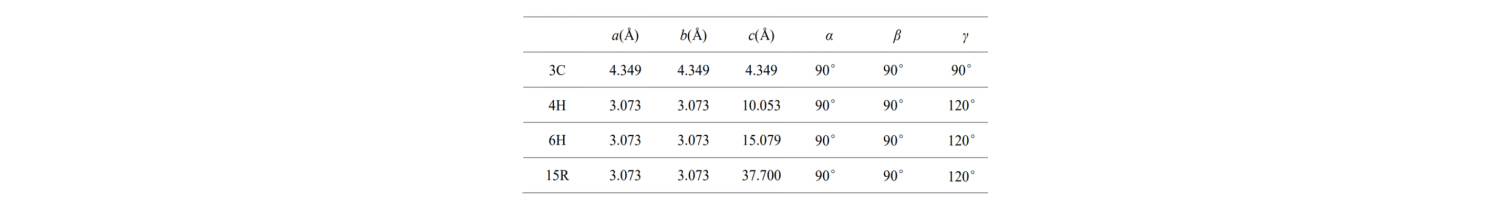
Základné parametre buniek týchto bežných typov kryštálov SiC sú uvedené v tabuľke:
Čo znamenajú a, b, c a uhly? Štruktúra najmenšej jednotkovej bunky v SiC polovodiči je opísaná takto:
V prípade tej istej bunky bude kryštálová štruktúra tiež iná, je to ako keby sme si kúpili lotériu, výherné číslo je 1, 2, 3, kúpili ste 1, 2, 3 tri čísla, ale ak je číslo zoradené inak je výherná suma iná, takže počet a poradie toho istého kryštálu možno nazvať rovnakým kryštálom.
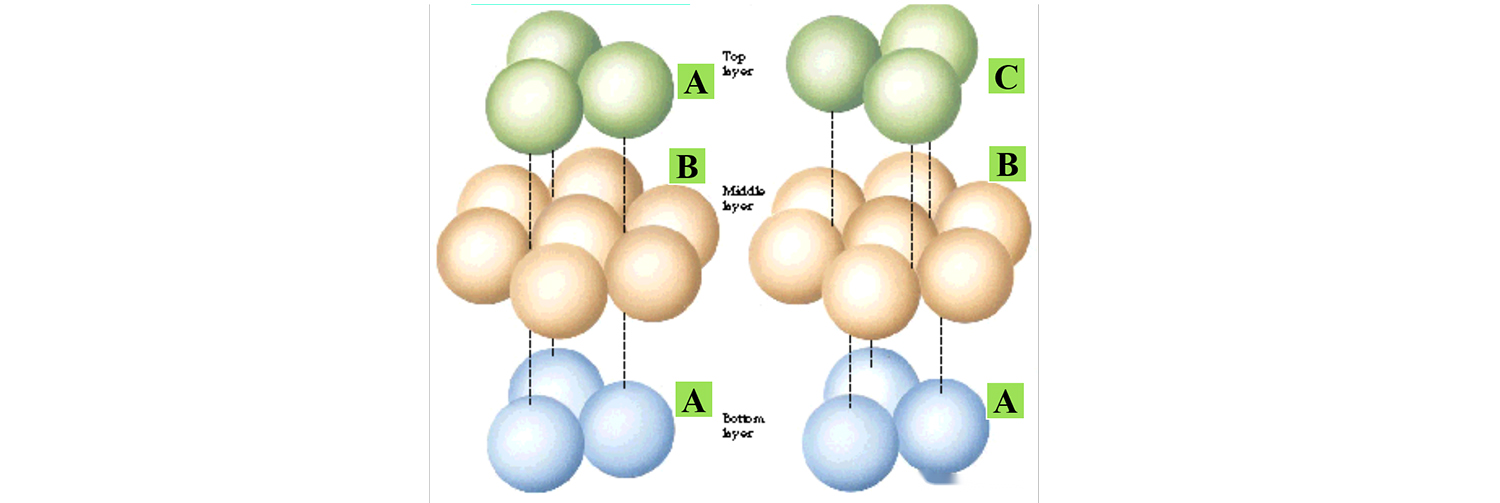
Nasledujúci obrázok ukazuje dva typické režimy stohovania, iba rozdiel v režime stohovania horných atómov, kryštálová štruktúra je odlišná.
Kryštalická štruktúra tvorená SiC úzko súvisí s teplotou. Pôsobením vysokej teploty 1900 ~ 2000 ℃ sa 3C-SiC pomaly premení na hexagonálnu polyformu SiC, ako je 6H-SiC, pretože má slabú štrukturálnu stabilitu. Práve kvôli silnej korelácii medzi pravdepodobnosťou tvorby polymorfov SiC a teplotou a nestabilitou samotného 3C-SiC sa rýchlosť rastu 3C-SiC ťažko zlepšuje a príprava je náročná. Šesťhranný systém 4H-SiC a 6H-SiC sú najbežnejšie a ľahšie sa pripravujú a sú široko študované kvôli svojim vlastným charakteristikám.
Dĺžka väzby SI-C väzby v kryštáli SiC je len 1,89A, ale väzbová energia je až 4,53eV. Preto je medzera úrovne energie medzi stavom väzby a stavom proti väzbe veľmi veľká a môže sa vytvoriť široká medzera v pásme, ktorá je niekoľkonásobkom Si a GaAs. Vyššia šírka pásma znamená, že vysokoteplotná kryštálová štruktúra je stabilná. Pridružená výkonová elektronika môže realizovať charakteristiky stabilnej prevádzky pri vysokých teplotách a zjednodušenú štruktúru odvodu tepla.
Pevná väzba Si-C väzby spôsobuje, že mriežka má vysokú vibračnú frekvenciu, to znamená vysokoenergetický fonón, čo znamená, že kryštál SiC má vysokú pohyblivosť nasýtených elektrónov a tepelnú vodivosť a súvisiace výkonové elektronické zariadenia majú vyššia rýchlosť spínania a spoľahlivosť, čo znižuje riziko poruchy prehriatia zariadenia. Okrem toho vyššia sila prierazného poľa SiC umožňuje dosiahnuť vyššie koncentrácie dopingu a nižšiu odolnosť proti prepuknutiu.
Po druhé, história vývoja kryštálov SiC
V roku 1905 doktor Henri Moissan objavil v kráteri prírodný kryštál SiC, ktorý sa podľa neho podobal diamantu a pomenoval ho diamant Mosan.
V skutočnosti už v roku 1885 Acheson získal SiC zmiešaním koksu s oxidom kremičitým a jeho ohrevom v elektrickej peci. V tom čase si ho ľudia mýlili so zmesou diamantov a nazývali ho šmirgľom.
V roku 1892 Acheson zlepšil proces syntézy, zmiešal kremenný piesok, koks, malé množstvo drevených triesok a NaCl a zahrial ho v elektrickej oblúkovej peci na 2700 ℃ a úspešne získal šupinaté kryštály SiC. Táto metóda syntézy kryštálov SiC je známa ako Achesonova metóda a je stále hlavnou metódou výroby brusív SiC v priemysle. Vzhľadom na nízku čistotu syntetických surovín a hrubý proces syntézy produkuje Achesonova metóda viac nečistôt SiC, zlú kryštálovú integritu a malý priemer kryštálov, čo je ťažké splniť požiadavky polovodičového priemyslu na veľké, vysoko čisté a vysoké -kvalitné kryštály a nemožno ich použiť na výrobu elektronických zariadení.
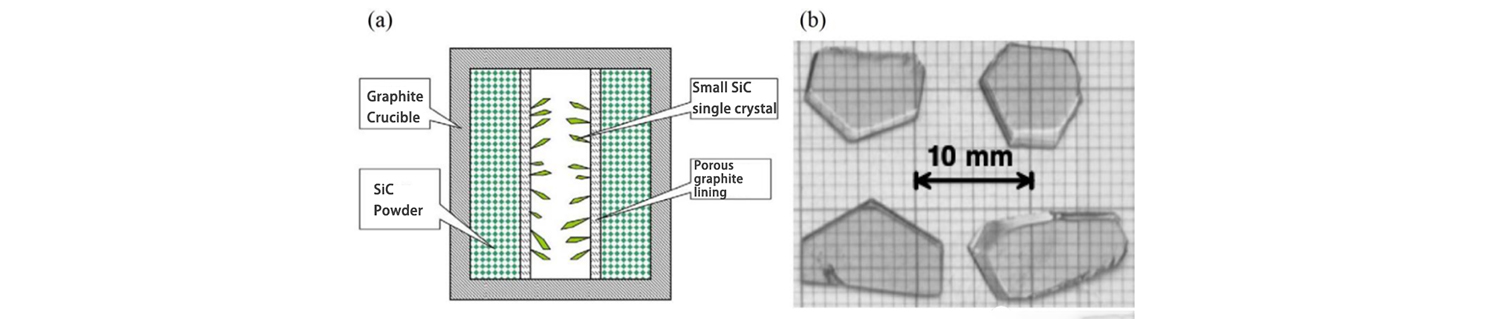
Lely z Philips Laboratory navrhla novú metódu pestovania monokryštálov SiC v roku 1955. Pri tejto metóde sa ako rastová nádoba používa grafitový téglik, práškový kryštál SiC sa používa ako surovina na pestovanie kryštálov SiC a porézny grafit sa používa na izoláciu dutá oblasť od stredu pestovateľskej suroviny. Pri raste sa grafitový téglik zahreje na 2500 ℃ pod atmosférou Ar alebo H2 a periférny prášok SiC sa sublimuje a rozkladá na látky v plynnej fáze Si a C a kryštál SiC rastie v strednej dutej oblasti po plyne. tok sa prenáša cez porézny grafit.
Po tretie, technológia rastu kryštálov SiC
Rast monokryštálov SiC je náročný vzhľadom na jeho vlastné charakteristiky. Je to spôsobené najmä skutočnosťou, že neexistuje žiadna kvapalná fáza so stechiometrickým pomerom Si: C = 1:1 pri atmosférickom tlaku a nemožno ju pestovať zrelšími rastovými metódami používanými v súčasnom hlavnom prúde procesu rastu polovodičov. priemysel - metóda cZ, metóda padacieho téglika a iné metódy. Podľa teoretického výpočtu, iba ak je tlak vyšší ako 10E5atm a teplota je vyššia ako 3200 ℃, možno získať stechiometrický pomer roztoku Si: C = 1: 1. Aby sa tento problém prekonal, vedci sa neustále snažili navrhnúť rôzne metódy na získanie vysoko kvalitných kryštálov veľkých rozmerov a lacných kryštálov SiC. V súčasnosti sú hlavnými metódami metóda PVT, metóda v kvapalnej fáze a metóda chemickej depozície pri vysokej teplote.
Čas odoslania: 24. januára 2024